Pengertian NaCl (Natrium Chlorida)
Natrium Chlorida
Pengertian NaCl (Natrium Chlorida)
Natrium klorida, juga dikenal dengan garam dapur, atau halit, adalah senyawa kimia dengan rumus molekul NaCl. Senyawa ini adalah garam yang paling memengaruhi salinitas laut dan cairan ekstraselular pada banyak organisme multiselular. Sebagai komponen utama pada garam dapur, natrium klorida sering digunakan sebagai bumbu dan pengawet makanan.
Garam dibuat dengan cara-cara berikut :
Penetralan larutan asam oleh larutan basa, disusul dengan penguapan dan pengkristalan. Dua larutan garam, karena pengendapan salah satu produk (natrium klorida + perak nitrat, perak klorida praktis semuanya mengendap) Pelelehan oksida basa atau senyawa dari oksida asam atau senyawanya. Pada proses ini karbon dioksida, amoniak, dan air akan terusir sebagai gas Reaksi antara logam dan unsur bukan logam (dengan pemanasan misalnya besi dan belerang).
Sodium Chlorida atau Natrium Chlorida (NaCl) yang dikenal sebagai garam adalah zat yang memiliki tingkat osmotik yang tinggi. Zat ini pada proses perlakuan penyimpanan benih recalsitran berkedudukan sebagai medium inhibitor yang fungsinya menghambat proses metabolisme benih sehingga perkecambahan pada benih recalsitran dapat terhambat.
Dengan kemampuan tingkat osmotik yang tinggi ini maka apabila NaCl terlarut di dalam air maka air tersebut akan mempunyai nilai atau tingkat konsentrasi yang tinggi yang dapat mengimbibisi kandungan air (konsentrasi rendah)/low concentrate yang terdapat di dalam tubuh benih sehingga akan diperoleh keseimbangan kadar air pada benih tersebut. Hal ini dapat terjadi karena H2O akan berpindah dari konsentrasi yang rendah ke tempat yang memiliki konsentrasi yang tinggi. Hal ini merupakan hal yang sangat menguntungkan bagi benih recalsitran, karena sebagaimana kita ketahui benih recalsitran yaitu benih yang memiliki tingkat kadar air yang tinggi dan sangat peka terhadap penurunan kadar air yang rendah. Kadar air yang tinggi menyebabkan benih recalsitran selalu mengalami perkecambahan dan berjamur selama masa penyimpanan atau pengiriman ketempat tujuan. Namun dengan perlakuan konsentrasi sodium chlorida (NaCl) maka hal ini dapat teratasi.
Senyawa-senyawa natrium (Na) banyak yang merupakan kebutuhan pokok industri. Ditinjau dari kandungan natriumnya (Na), kebanyakan senyawa itu berasal dari garam biasa. Di lain pihak, natrium (Na) dapat pula dianggap hanya sebagai pembawa daripada anion yang lebih efektif dalam garam itu yang merupakan gugus yang lebih penting bagi industri yang bersangkutan. Sebagai contoh pada natrium sulfida (Na2S), bagian yang terpenting adalah sulfidanya. Demikian pula dalam hal natrium tiosulfat (Na2SO3) dan natrium silikat (Na2Si). Terkadang yang digunakan adalah garam kalium (K) yang sejenis, tetapi biasanya garam natrium (Na) lebih murah biaya pembuatannya, khusussnya untuk kemurnian yang memadai bagi keperluan industri. Garam dapat diperoleh dengan tiga cara yaitu penguapan air laut dengan sinar matahari di pesisir pasifik atau dari air danau asin di daerah barat, penambahan batuan garam (rock salt) dan dari sumur air garam (brines).
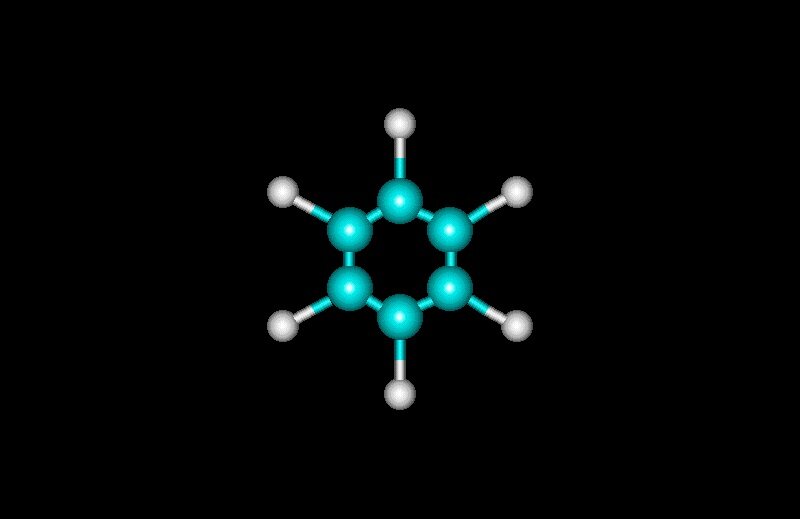
Natrium klorida (NaCl) mengkristal dalam bentuk kubus pusat muka (face centered cube, fcc). Untuk membayangkan bentuk ini perhatikan saja posisi salah satu ion-ion yang sama, ion-ion natrium (Na+) saja atau ion-ion klorida (Cl-) saja pada sistem satu unit sel kristal. Pada model kemas rapat natrium klorida (NaCl) terlihat delapan ion klorida (Cl-) (lingkaran terang-besar) menempati kedelapan sudut suatu kubus, enam ion klorida (Cl-) yang lain (lingkaran berbintik-besar) menempati ke enam pusat muka kubus ini. Jika kubus tersebut diperluas/diperpanjang dengan tambahan masing-masing satu muka lagi ke arah horizontal dan vertikal, maka akan terlihat bahwa setiap ion natrium (Na+) sesungguhnya menempati pusat setiap bangun oktahedron ion klorida (Cl-). Dengan demikian kristal natrium klorida (NaCl) dapat dikatakan mempunyai bangun kemas-rapat kubus pusat muka ion klorida (Cl-) dengan ion natrium (Na+) yang lebih kecil menempati rongga oktahedral. Selain itu, perluasan bangun ini juga akan memperlihatkan adanya bentuk kubus pusat muka yang dibangun oleh ion-ion natrium (Na+) seperti halnya dibangun oleh ion-ion klorida (Cl-). Oleh karena itu, kisi kristal natrium klorida (NaCl) merupakan dua kisi kubus pusat muka yang saling tertanam di dalamnya (interpenetrasi).
Garam dapur atau natrium klorida (NaCl). Zat padat berwarna putih yang dapat diperoleh dengan menguapkan dan memurnikan air laut. Juga dapat dengan netralisasi HCl dengan NaOH berair. NaCl nyaris tak dapat larut dalam alkohol, tetapi larut dalam air sambil menyedot panas, perubahan kelarutannya sangat kecil dengan suhu. Garam normal, suatu garam yang tak mengandung hidrogen atau gugus hidroksida yang dapat digusur. Larutan-larutan berair dari garam normal tidak selalu netral terhadap indikator semisal lakmus. Garam rangkap; yang terbentuk lewat kristalisasi dari larutan campuran sejumlah ekivalen dua atau lebih garam tertentu. Misalnya: FeSO4(NH4)2SO4.6H2O dan K2SO4Al4(SO4)3.24H2O. Dalam larutan, garam ini merupakan campuran berupa ion sederhana yang akan mengion jika dilarutkan lagi. Jadi, jelas berbeda dengan garam kompleks yang menghasilkan ion-ion kompleks dalam laruta.
Natrium klorida (NaCl) merupakan salah satu bahan yang banyak digunakan oleh masyarakat dalam pengolahan makanan dan bahan baku dalam berbagai industri kimia. Industri kimia yang paling banyak menggunakan natrium klorida (NaCl) sebagai bahan bakunya adalah industri klor alkali. Produk utama dari industri ini adalah klorin (Cl- ) dan natrium hidroksida (NaOH), yang banyak dibutuhkan oleh industri lain, seperti industri pulp dan kertas, tekstil, sabun dan pengolahan air limbah. Teknologi terbaru yang digunakan dalam industri klor alkali adalah elektrolisa larutan garam (brine). Teknologi ini digunakan karena harga bahan baku lebih murah, kemurnian produk lebih tinggi, tekanan dan temperatur operasinya rendah. Proses elektrolisa larutan garam umumnya menggunakan sel membran karena dibandingkan dengan sel diafragma dan sel merkuri, sel membran dapat menghasilkan produk elektrolisa dengan kemurnian lebih tinggi. Tetapi kelemahan dari sel membran itu sendiri adalah larutan garam yang diumpankan ke elektrolizer harus mempunyai kemurnian yang tinggi. Sampai saat ini pemisahan garam dari impuritasnya masih menjadi permasalahan yang cukup serius dalam industri klor alkali, terutama karena harus sering dilakukan penggantian sel membran dalam elektrolizer untuk dapat mengantisipasi kegagalan proses. Ada tiga macam pengaruh endapan terhadap membran, yaitu turunnya produksi akibat turunnya efisiensi membran, naiknya power listrik akibat naiknya tahanan membran dan turunnya umur membran.
Oleh karena itu diperlukan proses pemurnian larutan garam dari impuritasnya sebelum diumpankan ke elektrolizer. Proses pemurnian ini bertujuan untuk memaksimalkan efisiensi dari sel elektrolitik yang dilakukan dengan cara menghilangkan impuritas seperti ion kalsium (Ca2+) dan magnesium (Mg2+) yang terdapat dalam larutan garam. Impuritas-impuritas tersebut dapat bereaksi dengan ion karbonat (CO32-) sehingga akan membentuk endapan putih yaitu kalsium karbonat (CaCO3). Endapan-endapan yang terbentuk akan menutupi permukaan membran sehingga akan menghambat penyeberangan ion natrium (Na+) dari anoda ke katoda. Baku mutu larutan garam sebagai umpan elektrolizer adalah natrium klorida (NaCl) 300 ± 20 gram/ liter, ion kalsium (Ca2+) 10 ppm. Untuk penghilangan impuritas dari produk garam dapat dilakukan dengan berbagai cara antara lain dengan resin penukar ion. Akan tetapi proses ini memerlukan biaya yang besar untuk biaya pembelian dan regenerasi resin. Oleh karena itu digunakan senyawa kimia yaitu natrium karbonat (Na2CO3) yang harganya lebih murah. Dengan penambahan natrium karbonat (Na2CO3) dalam larutan garam akan terbentuk endapan kalsium karbonat (CaCO3) yang nantinya akan dipisahkan dalam larutan sehingga ion kalsium (Ca+) yang masih tersisa dalam larutan akan memenuhi baku mutu sebagai umpam elektroliser.
Klorida adalah ion yang terbentuk sewaktu unsur klor mendapatkan satu elektron untuk membentuk suatu anion (ion bermuatan negatif) Cl−. Garam dari asam hidroklorida HCl mengandung ion klorida; contohnya adalah garam meja, yang disebut Natrium klorida dengan rumus kimia NaCl. Dalam air, senyawaini terpecah menjadi ion Na+ dan Cl−. lebih atom klornya memiliki ikatan kovalen dalam molekul. Ini berarti klorida dapat berupa senyawa anorganik maupun organik. Contoh paling sederhana dari suatu klorida anorganik adalah hydrogen klorida(HCl), sedangkan contoh sederhana senyawa organik (suatu organoklorida) adalah klorometana(CH3Cl), atau sering disebut metil klorida.
Secara mendasar, proses pemisahan dapat diterangkan sebagai proses perpindahan massa. Proses pemisahan sendiri dapat diklasifikasikan menjadi proses pemisahan secara mekanis atau kimiawi. Pemilihan jenis proses pemisahan yang digunakan bergantung pada kondisi yang dihadapi. Pemisahan secara mekanis dilakukan kapanpun memungkinkan karena biaya operasinya lebih murah dari pemisahan secara kimiawi. Untuk campuran yang tidak dapat dipisahkan melalui proses pemisahan mekanis (seperti pemisahan minyak bumi), proses pemisahan kimiawi harus dilakukan.
Proses pemisahan suatu campuran dapat dilakukan dengan berbagai metode. Metode pemisahan yang dipilih bergantung pada fasa komponen penyusun campuran. Suatu campuran dapat berupa campuran homogen (satu fasa) atau campuran heterogen (lebih dari satu fasa). Suatu campuran heterogen dapat
mengandung dua atau lebih fasa: padat-padat, padat-cair, padat-gas, cair-cair, cairgas, gas-gas, campuran padat-cair-gas, dan sebagainya. Pada berbagai kasus, dua atau lebih proses pemisahan harus dikombinasikan untuk mendapatkan hasil pemisahan yang diinginkan.
Rekristalisasi merupakan salah satu cara pemurnian zat padat dimana zat-zat tersebut dilarutkan dalam suatu pelarut kemudian dikristalkan kembali. Cara ini bergantung pada kelarutan zat dalam pelarut tertentu jika suhu diperbesar. Karena konsentrasi total biasanya lebih kecil dari konsentrasi zat yang dimurnikan, bila dingin, maka konsentrasi yang rendah tetapi dalam larutan sementara produk yang berkonsentrasi tinggi akan mengendap. Peristiwa rekristalisasi berhubungan dengan reaksi pengendapan.
Peristiwa rekristalisasi berhubungan dengan reaksi pengendapan. Endapan merupakan zat yang memisah dari satu fase padat dan keluar ke dalam larutannya. Endapan terbentuk jika larutan bersifat terlalu jenuh dengan zat yang bersangkutan. Kelarutan suatu endapan merupakan konsentrasi molal dari larutan jenuhnya. Kelarutan bergantung dari suhu, tekanan, konsentrasi bahan lain yang terkandung dalam larutan dan komposisi pelarutnya.
Pada dasarnya pembuatan garam dari air laut terdiri dari langkah-langkah proses pemekatan (dengan menguapkan airnya) dan pemisahan garamnya (dengan kristalisasi). Bila seluruh zat yang terkandung diendapkan/dikristalkan akan terdiri dari campuran bermacam-macam zat yang terkandung, tidak hanya Natrium Klorida yang terbentuk tetapi juga beberapa zat yang tidak diinginkan ikut terbawa (impurities). Proses kristalisasi yang demikian disebut “kristalisasi total”.
Bila terjadi kristalisasi komponen garam tersebut diatur pada tempat-tempat yang berlainan secara berturut-turut maka dapatlah diusahakan terpisahnya komponen garam yang relatif lebih murni. Proses kristalisasi demikian disebut kristalisasi bertingkat. Untuk mendapatkan hasil garam natrium klorida yang kemurniannya tinggi harus ditempuh cara kristalisasi bertingkat, yang menurut kelakuan air laut, tempat kristalisasi garam (disebut meja garam) harus mengkristalkan air pekat dari 25°Be sehingga menjadi 29°Be, sehingga pengotoran oleh gips dan garam-garam magnesium dalam garam yang dihasilkan dapat dihindari/dikurangi.
Kristalisasi merupakan metode pemisahan untuk memperoleh zat padat yang terlarut dalam suatu larutan. Dasar metode ini adalah kelarutan bahan dalam suatu pelarut dan perbedaan titik beku. Kristalisasi ada dua cara yaitu kristalisasi penguapan dan kristalisasi pendinginan. Contoh proses kristalisasi dalam kehidupan sehari-hari adalah pembuatan garam dapur (NaCl) dari air laut. Mula-mula air laut ditampung dalam suatu tambak, kemudian dengan bantuan sinar matahari dibiarkan menguap. Setelah proses penguapan, dihasilkan garam dalam bentuk kasar dan masih bercampur dengan pengotornya, sehingga untuk mendapatkan garam yang bersih diperlukan proses rekristalisasi (pengkristalan kembali) Contoh lain adalah pembuatan gula putih dari tebu. Batang tebu dihancurkan dan diperas untuk diambil sarinya, kemudian diuapkan dengan penguap hampa udara sehingga air tebu tersebut menjadi kental, lewat jenuh, dan terjadi pengkristalan gula. Kristal ini kemudian dikeringkan sehingga diperoleh gula putih atau gula pasir.
Teknik ini melibatkan pelarutan padatan kotor dalam volume minimum pelarutan panas dan penyaringan untuk memindahkan pengotor yang tidak larut. Hasil larutan jenuh panas dari pada senyawa, bersama dengan suatu pengotor larut. Diatur sedemikian sehingga dingin pelan-pelan, dimana kristal senyawa murni yang terbentuk akan terpisah dari larutan. Larutan yang tersisa setelah kristalisasi biasanya disebut mother liquor. Proses kristalisasi adalah suatu proses kesetimbangan molekul dalam larutan ada dalam kesetimbangan dengan kisi-kisi kristalnya. Karena kisi-kisi kristal lebih teratur, berbeda dengan molekunya, seperti pengotor, akan dikeluarkan dari kisi-kisi dan akan kembali dalam kisi-kisi kristal dan pengotornya akan kembali kelarutan. Untuk berhasilnya kristalisasi, larutan harus dibiarkan dingin dengan pelan-pelan, dan proses kesetimbangan dimana pengeluaran pengotor dibiarkan terjadi. Jika larutan didinginkan dengan cepat, molekul-molekul pengotor diperangkap atau terliputi di dalam pertumbuhan kisi-kisi kristal yang tepat. Pembentukan padatan yang cepat dari larutan adalah pengendapan dan tidak sama dengan kristalisasi.
Kristal adalah suatu padatan yang atom, molekul, atau ion penyusunnya terkemas secara teratur dan polanya berulang melebar secara tiga dimensi. Kristal adalah benda padat yang mempunyai permukaan-permukaan datar. Karena banyak zat padat seperti garam, kuarsa, dan salju ada dalam bentuk-bentuk yang jelas simetris, telah lama para ilmuwan menduga bahwa atom, ion ataupun molekul zat padat ini juga tersusun secara simetris.
Secara umum, zat cair membentuk kristal ketika mengalami proses pemadatan. Pada kondisi ideal, hasilnya bisa berupa kristal tunggal, yang semua atom-atom dalam padatannya “terpasang” pada kisi atau struktur kristal yang sama, tapi, secara umum, kebanyakan kristal terbentuk secara simultan sehingga menghasilkan padatan polikristalin. Misalnya, kebanyakan logam yang kita temui sehari-hari merupakan polikristal.
Struktur kristal yang akan terbentuk dari suatu cairan tergantung pada kimia cairannya sendiri, kondisi ketika terjadi pemadatan, dan tekanan ambien. Proses terbentuknya struktur kristalin dikenal sebagai kristalisasi. Kristal bismut.Meski proses pendinginan sering menghasilkan bahan kristalin, dalam keadaan tertentu cairannya bisa membeku dalam bentuk non-kristalin. Dalam banyak kasus, ini terjadi karena pendinginan yang terlalu cepat sehingga atom-atomnya tidak dapat mencapai lokasi kisinya. Suatu bahan non-kristalin biasa disebut bahan amorf atau seperti gelas. Terkadang bahan seperti ini juga disebut sebagai padatan amorf, meskipun ada perbedaan jelas antara padatan dan gelas. Proses pembentukan gelas tidak melepaskan kalor lebur jenis (Bahasa Inggris: latent heat of fusion). Karena alasan ini banyak ilmuwan yang menganggap bahan gelas sebagai cairan, bukan padatan.
Kemudahan suatu endapan dapat disaring dan dicuci tergantung sebagian besar pada struktur morfologi endapan, yaitu bentuk dan ukuran-ukuran kristalnya. Semakin besar kristal-kristal yang terbentuk selamaberlangsungnya pengendapan, makin mudah mereka dapat disaring dan mungkin sekali (meski tak harus) makin cepat kristal-kristal itu akan turun keluar dari larutan, yang lagi-lagi akan membantu penyaringan. Bentuk kristal juga penting. Struktur yang sederhana seperti kubus, oktahedron, atau jarum-jarum sangat menguntungkan, karena mudah dicuci setelah disaring. Kristal dengan struktur yang lebih kompleks, yang mengandung lekuk-lekuk dan lubang-lubang, akan menahan cairan induk (mother liquid), bahkan setelah dicuci dengan seksama. Dengan endapan yang terdiri dari kristal-kristal demikian, pemisahan kuantitatif lebih kecil kemungkinannya bisa tercapai.
Endapan merupakan zat yang memisah dari satu fase padat dan keluar ke dalam larutannya. Endapan terbentuk jika larutan bersifat terlalu jenuh dengan zat yang bersangkutan. Kelarutan suatu endapan merupakan konsentrasi molal dari larutan jenuhnya. Kelarutan bergantung dari suhu, tekanan, konsentrasi bahan lain yang terkandung dalam larutan dan komposisi pelarutnya.
pengertian nacl, penjelasan nacl